Препараты платины для химиотерапии. Химиотерапия на основе платины и иммунотерапия – эффективный альянс при лечении рака

Обратите внимание, противораковые антибиотики не имеют ничего общего с традиционными антибиотическими препаратами. Принцип действия антибиотиков основан на замедлении деления генов раковых клеток. Самый популярный препарат данной группы – Адриамицин. Данный препарат используют в схеме с Цитотоксином.
Антиметаболиты
Принцип действия данных препаратов основан на встраивании в генетический аппарат раковой клетки. Когда раковая клетка начинает делиться, она погибает от действия препарата. К данной категории относится: 5-фторураци и Гемцитабин (Гемзар).
Антрациклины
Препараты данной группы имеют в своем составе антрациклиновое кольцо, которое взаимодействует с ДНК раковых клеток. Химиопрепараты ингибируют топоизомеразу-II и образуют свободные радикалы, которые и повреждают ДНК структуру раковых клеток. Представители данной группы препаратов: Рубомицин, Адрибластин.
Винкалкалоиды
Препараты для химиотерапии растительного происхождения (лекарственное растение Vinca rosea). Механизм действия основан на связывании белка тубулина, который формирует цитоскелет. Цитослекет – это неотъемлемая часть клетки, которая наблюдается при митозе и в фазе покоя. Уничтожение цитоскелета приводит к нарушению миграции хромосом в процессе деления клетки, что приводит к ее гибели. Особенность данного препарата в том, что к его действию более чувствительны раковые клетки, а не здоровые. Благодаря этому, лекарство имеет минимальные побочные эффекты. К данной группе препаратов относятся: Винбластин, Виндезин, Винкристин.
Препараты платины
Платина – это тяжелый металл, который токсичен для человеческого организма. Механизм действия платины схож с алкилирующими агентами. После попадания внутрь препарат взаимодействует с ДНК клетками, разрушая их структуру и функции.
Эпиподофиллотоксины
Являются синтетическими аналогами экстракта мандрагоры. Препарат воздействует на ядерный фермент топоизомеразу-II и ДНК. Препараты из данной группы: Тенипозид, Этопизид.
Другие цитостатики
Имеют комбинированный принцип действия, которые схож со всеми вышеописанными препаратами. Так, часть цитостатиков по механизму действия схожи с алкилирующиси агентами (Прокарбизин, Дакарбазин), часть подавляет топоизомеразу, а часть работает как антиметаболиты (Гидроксимочевина). Хорошими цитотастатическими свойствами обладают кортикостероиды, которые также используют для лечения онкологических заболеваний.
Таксаны
Данные препараты воздействуют на микротрубочки. К категории таксанов относят: Паклитаксел, Доцетаксе и таксаны, обладающие функциональными свойствами. Препараты для химиотерапии стабилизируют микротрубочки и не допускают их деполимеризации. Это нарушает нормальный процесс реструктурирования микротрубочек в клетке, что имеет существенное значение для процесса деления раковых клеток.
Каждая из вышеописанных групп химиопрепаратов имеет свои особенности, принцип действия и побочные эффекты. Кроме того, для использования каждого из препаратов, онкологи разрабатывают специализированные протоколы лечения. Протоколы эффективны даже при минимальном негативном влиянии на организм. Все лечебные протоколы постоянно совершенствуются в лучших мировых клиниках по лечению онкологии. Это повышает выживаемость пациентов с онкологией и улучшает качество их жизни.
Препараты для восстановления после химиотерапии
Препараты для восстановления после курса химиотерапии – это лекарственные средства, которые позволяют восстановить здоровье и уменьшить побочную симптоматику химиолечения. Для реабилитационного процесса могут использоваться как традиционные лекарственные препараты, так и фитопрепараты. Восстановительный курс составляется индивидуально для каждого больного. Лечение рекомендуется начинать сразу после окончания курса химиопроцедур или одновременно с приемом химиопрепаратов для уменьшения побочной симптоматики и защиты органов от действия противораковых лекарств.
Патологическое состояние или химическая болезнь развивается из-за приема одного или нескольких лекарственных препаратов. Заболевание называют побочными эффектами лекарственных средств, так как они являются частью механизма их действия. Восстановления после курса химиотерапии или профилактика химической болезни зависит от типа химиолечения и пораженных раком органов.
Давайте рассмотрим самые эффективные препараты для восстановления после химиотерапии и процесс восстановления пораженных органов:
- Восстановление почек
После курса химиотерапии при поражении почек, пациенты страдают от постоянной рвоты и диареи. Это очень опасное состояние, так как вместе со рвотой и поносом из организма в больших количествах выводится соляная кислота и натрия хлорид, без которых невозможна нормальная работа надпочечников и почек. Надпочечники перестают вырабатывать гормон адреналин, глюкортикоиды и минералокортикоиды. Подобная симптоматика соответствует острому течению химической болезни. Для восстановления почек используют такие препараты, как: Уропрот, Урометоксан.
- Восстановление крови
Такие показатели, как общий анализ крови, биохимия крови, СОЭ и лейкоцитарная формула – это показатели, которые отвечают за здоровое состояние крови и всех органов. Именно по этим критериям оценивают эффективность химиотерапии и общее состояние пациента. Если пациент избежал первой стадии химической болезни, то вскоре наступает вторая, длительность которой до 7 дней. Именно в этот период у пациентов появляется отечность, инфильтрация, некроз и разрушение эпителия желудочно-кишечного тракта и ростков костного мозга.
Подобное состояние сопровождается гибелью эритроцитарных ростков костного мозга, что приводит к массивным нарушениям обменных процессов. Как результат – анемия, тромбоцитопения, лейкопения. У пациентов появляются кровотечения, синяки, возможны кровоизлияния во внутренние органы. Процесс восстановления крови заключается в переливании эритроцитарных и тромбоцитарных масс и как радикальная терапия – пересадка костного мозга. Но такой восстановительный процесс имеет свои недостатки. Около 45% пациентов заражаются вирусом гепатита С, В и другими вирусами, которые сопровождают на протяжении всей жизни. Существует ряд препаратов, которые позволяют восстановить кровь после химиотерапии: Филстим, Нейпоген, Зарсиум, Грастим.
- Восстановление микрофлоры и иммунной системы
На фоне пониженной иммунной системы после курса химиотерапии, у пациентов начинает развиваться инфекция, а условно-патогенная флора приобретает болезнетворные свойства. Из-за общей интоксикации организма, пациенты страдают от грибковых инфекций. Так, в 100% случаев, у пациентов развивается кандидоз. Возможно развитие стафилококка, который распространяется по всем мельчайшим артериям. Из-за этого у больного появляются очаги воспаления, множественные очаги некроза с перфорацией кожи, сепсис, кровотечения и тромбозы.
В 70% случаев, отсутствие восстановительной терапии приводит к смерти. Для предупреждения развития вышеописанного состояния, восстановления иммунитета и микрофлоры, пациентам назначают такие препараты, как: Лакта, Лациум, Лактовит-Форте, витамины группы В, Нейрорубин, Аскорбиновая кислота.
- Восстановление печени
После курса химиотерапии от эффективности работы печени зависит функционирование органов и систем и резервные возможности тканей и органов организма. Печеночная ткань является главным буфером по переработке, выведению и получению веществ из организма. Любой химиопрепарат или просто лекарственный препарат, введенный в организм, выводится с помощью печени и влияет на печеночную функцию.
Прямое сильное воздействие, оказывают на печень активные вещества и их метаболиты, а косвенное – сопутствующие эффекты, которые они вызывают в организме. Так, изменение в параметрах крови, приводит к затруднению функции гепатоцитов, повреждает почки и дают сильную нагрузку токсических веществ на печень. Из-за инфекции клетки печени могут выйти из строя. Для восстановления печени, используют такие препараты: Гепадиф, Глуроргин, Карсил, Эссенциале Форте-Н.
- Восстановление сердечно-сосудистой системы
Многие пациенты перед операцией или до приема химиопрепаратов, страдают от вегето-сосудистой дистонии и гипертонии. Но после удаления источника токсинов, то есть опухоли, давление стабилизируется. Так, к примеру, Доксорубицин образует свободные радикалы, которые усиливают повреждение мембран. Из-за этого препарат считается одним из самых кардиотоксических. Для восстановления сердечно-сосудистой системы после химиотерапии, используются такие препараты, как: Аспоркам, Предуктал, Милдрокарт.
- Восстановление кишечника и пищеварительной системы
Негативные последствия химиотерапии больше всего проявляются со стороны кишечника. Пациенты страдают от рвоты, чувства тошноты и диареи. Но на сегодняшний день нет средств, которые бы полностью защищали слизистую оболочку кишечника от воспалительного процесса. Из-за этого больные жалуются на опоясывающие боли, нарушения пищеварения, отсутствие аппетита, диарею, жидкий стул, понос, колит, запоры. У некоторых пациентов из-за нарушений пищеварительной системы и кишечника появляется кандидоз, диспепсия и дисбактериоз. Поскольку воспаленный кишечник не способен полноценно переваривать пищу, то для восстановления после курса химиотерапии, используют такие препараты, как: Лакта, Проксиум, Нексиум, Квамател.
- Профилактика депрессии
Очень часто после химиотерапии у пациентов из-за взаимодействия медикаментов появляется депрессия, которая проявляет себя как дуоденит. Дуоденальная депрессия возникает из-за выработки в двенадцатиперстной кишке не только пищеварительных гормонов, но и гормонов общего действия, которые влияют на человеческое поведение. Из-за воспалительного процесса нарушается баланс нейропептидов. Для борьбы с данным недугом, используют такие препараты, как: Афабазол, Фезам и другие.
Восстановительное лечение заключается в применении препаратов из групп стероидных и нестероидные противовоспалительных средств, антигипоксантов, антиоксидантов, обезболивающих и витаминов. Но медикаментозная терапия не всегда приносит желаемые результаты. Многие пациенты отдают преимущество восстанавливать организм с помощью натуральных и безопасных методов. Для этих целей используют сопроводительную фитотерапию и проводят фитооздоровление.
Сопроводительная фитотерапия представляет собой применение растительных вытяжек, которые обладают высокой противовоспалительной активностью. Процесс фитолечения заключается в проведении фитодетоксикации и фитооздоровления на всех этапах лечения онкобольного. Терапия заключается в профилактике отдаленных последствий облучения и химиотерапии, а также в предупреждении рецидивов заболевания.
Препараты платины для химиотерапии
Препараты платины для химиотерапии – это современный и эффективный метод лечения раковых заболеваний. К примеру, самый популярный препарат платины – Цисплатин был опробован еще в 1978 году в США. Изначально препарат разрабатывался для лечения рака яичка, но на сегодняшний день применяется для лечения раковых поражений легких, при раке яичников и при лимфомах. Но даже препараты платины вызывают побочные эффекты, которые проявляются как ярко выраженное токсическое действие и формирование лекарственной резистентности на клеточном уровне.
Среди пациентов с раковыми заболеваниями бытует мнение, что если начали применять препараты платины, то дела совсем плохи. Но на самом деле это не так. Химиотерапия платиной используется в том случае, когда другие препараты не дали должного результата. Это относится к раковым поражениям мочевого пузыря, легких, яичников и других онкологических заболеваний. Самым существенным противопоказанием к применению препаратов платины является – выраженная почечная недостаточность. Из-за этого терапия становится менее прогрессивной.
На сегодняшний день, вместо препарата Цисплатины планируют использовать Фенантриплатин, который эффективнее проникает в пораженные онкологией клетки и ингибирует транскрипцию. Механизм действия препаратов платины заключается в цитостатическом воздействии, которое полностью основано на появлении в ДНК продольных и внутрицепочных связей, формирующих препятствия к репликации. Это возникает из-за состава препаратов, основа которых – платиновый атом с двумя ионами хлора и аммониевыми лигандами.
Среди всех тяжелых металлов, лишь соединения платины – Карбоплатин и Цисплатин применяются как противоопухолевые препараты. Данные средства не относятся к алкилирующим препаратам, так как они формируют перекрестные сшивки ценней ДНК. Рассмотрим детальнее лекарственные препараты на основе платины:
Цисплатин
Противоопухолевый препарат, производный платины. Средство обладает способностью к разрушению ДНК раковых клеток, вызывая регрессию опухолей и метастазов. Особенность данного препарата в том, что он неэффективен при приеме внутрь. А вот при внутривенном применении, препарат быстро и в больших дозах поступает в органы и системы. Цисплатин не проникает через гематоэнцефалический барьер, а связываемость с белками крови находится на уровне 90%. Выводится почками, медленно, в первые часы выходит около 40% препарата, остальное количество в течение пяти дней с момента введения.
- Показания к применению. Цисплатин используется как в комплексной терапии, в сочетании с противоопухолевыми антибиотиками и другими препаратами, так и в качестве монотерапии. Лекарственное средство используют для лечения злокачественных поражений яичников, мочевого пузыря, яичек, при раке шейки матки, остеогенной саркоме, плоскоклеточном раке головы. Цисплатин эффективен в составе комплексной терапии при лечении рака лимфатической системы, лимфосаркомы.
- Способ применения. Раствор Цисплатин вводят внутривенно. Если используется монохимиотерапия, то пациенту вводят 20 мг препарата на 1 м² поверхности тела, в течение пяти дней или по 30 мг в течение трех дней. Более высокая дозировка в 100-150 мг подразумевает введение препарата раз в три недели. Интервал между курсами должен составлять не менее трех недель. Количество курсов определяется индивидуально для каждого пациента. При введении, 10 мг Цисплатин растворяют в 10 мл стерильной воды для инъекций, полученный раствор разводят в 1000 мл изотонического раствора натрия хлорида или в 5% растворе глюкозы. Вводят препарат струйно, в виде длительных инфузий. Для того чтобы минимизировать негативное воздействие на почки, перед введением Цисплатин рекомендуется гидратировать организм больного.
- Цисплатин может вызывать нарушения в работе почек, провоцировать приступы тошноты, рвоты, головокружение, потерю аппетита, понижение слуха или шум в ушах. Возможны аллергические реакции и резкое понижение лейкоцитов и тромбоцитов в крови. У некоторых пациентов, Цисплатин вызывает нейропатию, которая поражает нервы нижних конечностей. В процессе введения препарата, пациент может ощущать боль по ходу вены.
- Противопоказания. Цисплатин не рекомендуется использовать при нарушениях функций печени и почек, проблемах с костномозговым кроветворением, при язве желудка, беременности и индивидуальной непереносимости препарата. Цисплатин противопоказано сочетать с лекарственными средствами, которые повреждают почки и органы слуха, а также с стрептомицином и антибиотиками-аминогликозидами.
- Препарат выпускают в ампулах для инъекций по 0,001 по 10 штук в упаковке. Цисплатин представляет собой желтоватую массу неоднородной окраски, которая легко распадается в порошок. Хранить Цисплатин необходимо в защищенном от солнечного света месте, при температурном режиме не выше +10 °С. Отпускается только по рецепту.
Карбоплатин
Противоопухолевое средство, группы платиновых производных. Механизм действия основан на подавлении биосинтеза нуклеиновых кислот и гибели раковых клеток. В отличие от препарата Цисплатин, Карбоплатин имеет минимальное повреждающее воздействие на почки, ототоксичность и нейротоксичность.
- Показания к применению. Карбоплатин назначают пациентам с раковыми поражениями яичников, яичек, при семиноме, меланоме, раке шейки матки, раке мочевого пузыря, остеогенной саркоме, опухолях шеи и головы.
- Применяют препарат только внутривенно. Взрослым пациентам вводят по 400 мг на 1 м² поверхности тела в течение 20-60 минут. Введение препарата проводят с перерывом в месяц. Карбоплатин растворяют в стерильной воде для инъекций: 5% растворе глюкозы или изотоническом растворе натрия хлорида. Срок годности приготовленного раствора составляет 8 часов. Карбоплатин не используют одновременно с препаратами, оказывающими нефротоксическое и нейротоксическое действие. Данный препарат платины для химиотерапии применяют только под наблюдением врача. Перед курсом лечения, пациенту проводят проверку функциональных характеристик почек и неврологическое обследование. Вводят препарат с помощью наборов и игл внутривенного вливания с элементами алюминия.
- Карбоплатин вызывает побочные действия, которые проявляются как угнетение функции кроветворения, уменьшение количества тромбоцитов и лейкоцитов в крови, снижение гемоглобина в крови, повышение креатина и мочевины в крови. Препарат провоцирует появление тошноты, рвоты, кожные аллергические реакции, снижение слуха, поражение периферических нервов, нарушения чувствительности, мышечную слабость. Из-за использования Карбоплатин у пациентов возможно частичное или полное выпадение волос, озноб и гипертермия.
- Препарат платины противопоказано применять для пациентов с выраженными нарушениями функции почек и повышенной чувствительностью к препаратам платины. Поскольку препарат способен оказывать канцерогенное действие, то есть вызывать рак, то персонал, работающий с Карбоплатин должен быть предельно осторожен.
- Выпускают Карбоплатин во флаконах, как стерильный лиофилизированный порошок для инъекций. Препарат выпускают в дозировке по 0,05, 0,15, 0,2 и 0,45 г во флаконах. Карбоплатин выпускают и в форме раствора для инъекций, в ампулах по 5, 15 и 45 мл.
Фенантриплатин
Новый экспериментальный противоопухолевый препарат. Данное лекарственное средство показало себя эффективнее, чем препарат Цисплатин. Фенантриплатин полностью разрушает раковые клетки и препятствует выработке резистентности к препаратам платины. Кроме того, данный препарат охватывает более широкий спектр онкозаболеваний.
Фенантриплатин обладает рядом преимуществ перед Цисплатином. Препарат легче и быстрее проникает в раковые клетки и ингибирует транскрипцию, то есть преобразовывает ДНК в РНК. В исследовании препарата использовалось более 60 типов раковых клеток. Фенантриплатин показал эффективность в 40 раз выше, чем Цисплатин в борьбе с раковыми клетками. Поскольку раковые клетки способны формировать устойчивость к действию препаратов, в состав Фенантриплатин входит трехчленное кольцо, которое защищает платиновый препарат от атак со стороны.
На сегодняшний день препарат подтвердил свою эффективность в опытах, проводимых в лабораториях. Теперь Фенантриплатин предстоит испытать на животных для подтверждения противоопухолевого действия.
Препараты для печени после химиотерапии
Препараты для печени после химиотерапии позволяют восстановить пораженный орган. Печень необходимо лечить в обязательном порядке, так как во время химиотерапии орган подвергается сильной атаке тяжелыми элементами, токсинами, которые выводятся в течение длительного периода времени. Печень выполняет несколько функций. Орган принимает активное участие в обмене веществ, оказывает защитную функцию, обезвреживая токсические элементы, и выводит из организма различные вещества с желчью, выполняя выделительную функцию. В период химиотерапии на орган ложатся дополнительные функции. Печень превращает большинство лекарственных препаратов в активную форму, понижая их токсическое действие. Состояние печени влияет на эффективность терапии. Так, заболевания органа оказывают токсическое и лечебное действие на препараты. Все используемые препараты для химиотерапии повреждают печень.
После курса химиотерапии на печень ложится еще большая нагрузка. Так как орган должен уменьшить токсичность препаратов. То есть печень необходимо защищать, поддерживать и восстанавливать. Перед курсом химиолечения врач-онколог берет у пациента биохимический анализ крови. Это связано с тем, что многие лекарственные препараты оказывают негативное влияние на орган и даже могут менять ее строение. Некоторые химиопрепараты действуют как прямые печеночные яды, но их действие имеет прогнозируемый характер. Поэтому задача врача, вовремя назначить препараты для восстановления печени после химиотерапии. В любом случае, степень нарушений функции печени непредсказуемая и зависит не только от дозировки препаратов химии, но и от индивидуальных особенностей организма больного.
Печеночную недостаточность из-за химиотерапии выявить нетрудно, главное вовремя обратить внимание на такую симптоматику, как:
- Желтизна кожных покровов, слизистых оболочек глаз и полости рта.
- На коже появляются кровоизлияния и сосудистые звездочки.
- При проведении биохимического анализа, врачи отмечают многообразие изменений в крови.
Начальную степень поражения можно распознать только при биохимическом анализе крови. Именно поэтому, перед каждым курсом химиотерапии, кровь пациента исследуют на ферменты и билирубин. При применении высокотоксических препаратов химии, печень начинают защищать с первых дней лечения.
Мягкими восстанавливающими протекторами печени являются витамины группы В. Витамин В12(пангамат кальция) назначают в течение всей химиотерапии. Препарат принимают по 2 таблетки 3 раза в сутки. Высокими восстанавливающими и защитными свойствами обладает препарат Карсил. Препарат принимают по 1 таблетке, 3 раза в сутки. Поливитаминные комплексы – это еще одна защита для печени. Вышеописанные препараты назначают и тем онкобольным, которые перенесли желтуху или страдали или страдают от хронического алкоголизма.
Если перед очередным курсом химиотерапии или в процессе лечения у пациента обнаруживают поражения печени, то больному назначают Эссенциале. Данный препарат настолько популярен, что его известность превышает его эффективность и лекарственные свойства. Препарат необходимо принимать в течение 2-4 месяцев, а для получения быстрого эффекта, лекарственное средство вводится внутривенно 5-10 инъекций. Препараты для восстановления печени после химиотерапии называются гепатопротекторными лекарственными средства, давайте рассмотрим самые эффективные из них:
Карсил
Лекарственный препарат, применяемый для восстановления печени после курса химиотерапии. Мембраностабилизирующее действие активного вещества препарата уменьшает повреждающее влияние агрессивных токсических веществ на гепатоциты и снижает повреждение клеток печени. Препарат обладает антиоксидантными свойствами и оптимизирует метаболизм на клеточном уровне. Действующее вещество Карсил – силимарин, улучшает общее состояние пациента (аппетит, процессы пищеварения) и нормализуется клинические анализы. Выводится препарат, как правило, почками.
- Основные показания к применению препарата – циррозы печени, а также хронические гепатиты вирусной и токсической этиологии. Карсил эффективен при восстановлении печени после курса химиотерапии и перенесенных заболеваний с осложнениями на печень.
- Лекарственное средство принимают от 1 до 4 раз в сутки, в зависимости от индивидуальных потребностей организма и тяжести заболевания. При этом курс лечения должен составлять как минимум 90 дней.
- Побочные действия Карсил проявляются в виде диспепсии, вестибулярных нарушений и алопеции. Вышеописанная симптоматика проходит самостоятельно, после отмены приема препарата.
- Карсил противопоказано принимать при индивидуальной непереносимости компонентов препарата и при аллергических реакциях на составляющие лекарственного средства. Карсил можно комбинировать с другими препаратами, так как нет данных о неблагоприятном взаимодействии.
- При передозировке препаратом возможно появление рвоты и тошноты. Для устранения неблагоприятной симптоматики, необходимо промыть желудок, провести симптоматическую терапию и принять сорбенты.
- Карсил выпускают в таблетках. Препарат необходимо хранить в защищенном от солнечного света и недоступном для детей месте. Температура хранения не должна превышать 16-25 градусов. Препарат отпускается из аптек без рецепта врача.
Эссенциале
Эффективный печеночный препарат с активными веществами эссенциальными фосфолипидами. Действующие вещества принимают активное участие в регенарации, дифференциации и делении клеток. Благодаря этому, препарат регулирует проницаемость клеточной оболочки и улучшает функции мембран. Фармакологические свойства Эссенциале направлены на восстановление поврежденных клеток печени, улучшает детоксикационную функцию печении, нормализует ее работу.
- Основные показания к применению препарата – острые и хронические гепатиты, некроз и цирроз клеток печени, токсические поражения, прекома и печеночная кома, жировая дегенерация, пред и послеоперационное лечение. Препарат эффективен при нейродермитах, радиационном синдроме и псориазе.
- Эссенциале выпускают в форме капсул и инъекций для внутривенного введения. Капсулы принимают три раза в сутки по две штуки, в качестве поддерживающей терапии. Что касается внутривенных инъекций, то препарат вводят медленно, от 5 мл в сутки до 20 мл в тяжелых случаях. За один раз разрешается вводить не более 10 мл препарата. Инъекции проводят в течение 10 дней, после чего рекомендуется продолжить парентеральную терапию капсулами Эссенциале. Курс лечения занимает от 3 до 6 месяцев.
- Побочная симптоматика препарата проявляется при передозировке. Эссенциале вызывает желудочно-кишечное расстройство и тошноту. Лечение симптоматическое. Эссенциале противопоказано применять для пациентов с повышенной чувствительностью к компонентам лекарственного средства. ], [
- Основные показания к применению препарата: острые, хронические гепатиты и гепатозы, алкогольный стеатоз, отравление токсинами, промышленными и медикаментозными ядами. Лечение и восстановление печени после химиотерапии, неправильного питания. Энерлив оказывает положительный эффект при неэффективности немедикаментозных методов восстановления печени.
- Препарат принимают по две капсулы три раза в день, запивая обильным количеством воды. Длительность приема препарата подбирается врачом, индивидуально для каждого пациента.
- Побочные эффекты Энерлив проявляются в виде расстройства желудочно-кишечного тракта, диареи, болей в эпигастральной области. В редких случаях, препарат вызывает аллергические реакции (сыпь, крапивница, экзантема) и кровоизлияния (кровотечения в межменструальный период, петехиальные высыпания).
- Энерлив противопоказано принимать при индивидуальной непереносимости компонентов препарата, при аллергии на сою и арахис, при антифосфолидном синдроме в анамнезе. При взаимодействии препарата с антикоагулянтами кумаринового ряда, рекомендуется корректировать дозировку лекарственных средств, так как возможен синергизм действия.
Помимо вышеописанных препаратов для восстановления печени после химиотерапии, регенерирующими свойствами для органа и оздоравливающими для организма свойствами обладает диета. Диетическое питание подразумевает отказ от жаренного, тушеного, жирного и сладкого. Под запрет попадают жирные сорта рыбы и мяса, копчености, соленья, колбаса и другие продукты, богатые холестерином. В период восстановления печени категорически запрещено употреблять грибы, репу, фасоль, горох, шпинат, лук и холодные напитки.
Диетологи и врачи делают акцент на вегетарианский режим питания. Больному рекомендуется кушать овощные блюда и супы, молочное. Полезными будут мясные блюда, приготовленные на пару, нежирные отварные сорта мяса, нежирная рыба. Разрешается употреблять нежирный творог с медом, молоком и молочными продуктами, а также неострые сыры. При любых поражениях печени, а особенно в восстановительный период, в рационе должны быть спелые ягоды, фрукты, сухофрукты, фруктово-ягодные соки, отвары, пшеничные отруби. При этом суточный рацион должен состоять из 90г белка, 80г жиров и 400г углеводов. То есть суточная калорийность не должна превышать 3000 кКал.
],Catad_tema Опухоли женской половой системы - статьи
Химиотерапия паклитакселом в сочетании с препаратом платины по сравнению с обычной химиотерапией препаратом платины у женщин с рецидивом рака яичников: испытание ICON4/AGO-OVAR-2.2
Участники испытаний ICON и AGO*
РЕЗЮМЕ
История вопроса .
Несмотря на успехи в лечении рака яичников, у большинства больных в пределах трех лет после постановки диагноза развивается рецидив заболевания. Единого мнения относительно лечения второй линии в случае рецидива в настоящее время нет. Мы провели оценку комбинации паклитаксела с препаратом платины в качестве схемы для такого лечения.
Методы .
В параллельных международных многоцентровых рандомизированных испытаниях с января 1996 по март 2002 г.г. из 119 больниц пяти стран в испытание было включено 802 больных с рецидивом чувствительного к препаратам платины рака яичников. Рецидив у больных произошел после шестимесячного периода, в течение которого лечение им не проводили. Эти больные были рандомизированы на химиотерапию комбинацией паклитаксел/платина или на обычную химиотерапию препаратом платины. Анализ, за исключением учета токсических эффектов, проводился по отношению ко всем исходно намеченным для лечения больным.
Результаты .
За медианный срок наблюдения, составлявший 42 месяца, скончалось 530 больных. Кривые выживания говорят о преимуществе комбинации паклитаксел/платина (отношение риска 0,82 , р=0,02), что дает абсолютную разницу для выживания за два года, равную 7%, между группой паклитаксел/платина и группой обычного лечения (57 и 50% ), и разницу в медианном выживании, равную 5 месяцам (29 и 24 месяца) . У 717 больных отмечалась прогрессия заболевания или они скончались. Кривые выживаемости в отсутствие прогрессии заболевания обнаруживают различие в пользу комбинации паклитаксел/платина (отношение риска 0,76 , р=0,0004), что соответствует абсолютной разности для годичного выживания при отсутствии прогрессии, равной 10% (50 и 40% ) и для разности медианной выживаемости в отсутствие прогрессии заболевания, равной 3 месяцам (13 и 10 месяцев ).
Интерпретация .
Комбинация паклитаксел/платина дает лучшую, по сравнению с обычной химиотерапией препаратом платины, общую выживаемость и выживаемость без прогрессии заболевания среди больных с рецидивом чувствительного к препарату платины рака яичников.
Введение
Рак яичников является четвертым по распространенности раком среди женщин, отвечающим (по оценочным данным) за 114 000 летальных исходов во всем мире на 2000 год.1 Лечение этого заболевания на протяжении последних тридцати лет улучшилось за счет успехов в проведении хирургической операции и химиотерапии на основе препаратов платины, однако у большинства женщин с раком яичников развивается рецидив, и они умирают в пределах пяти лет.
Единое мнение относительно оптимального лечения второй линии при рецидиве заболевания отсутствует, несмотря на несколько имеющихся препаратов. Лечение первой линии осуществляют путем химиотерапии, основанной на препаратах платины, причем все чаще используют карбоплатин (в комбинации с таксаном или без него), а не цисплатин, поскольку карбоплатин обладает меньшей токсичностью при одинаковой активности.2,3 При рецидиве заболевания вероятность ответа на повторную химиотерапию, основанную на препарате платины, зависит от длительности периода, в течение которого препарат платины не применялся.4 Когда такой период превышает шесть месяцев, многие клиницисты предпочитают повторное лечение больных препаратом платины с использованием ранее применявшегося препарата или переводя больную с карбоплатина на цисплатин или наоборот. Женщины, заболевание которых прогрессировало в условиях исходного лечения препаратом платины, а также те, у которых рецидив развивается в пределах шести месяцев после исходного лечения препаратом платины, редко отвечают на продолжение лечения препаратом платины и считаются имеющими заболевание, резистентное к платине. Для таких больных в качестве активного лекарственного препарата и был впервые предложен паклитаксел.5 Этот препарат обычно хорошо переносится, наиболее частыми побочными эффектами являются алопеция, миелосупрессия и нейропатии.
У большинства больных заболевание не является резистентным к платине, однако в пределах шести месяцев или более длительного срока после лечения первой линии у них развивается рецидив.6 Неясно, будет ли применение такого препарата, как паклитаксел, обладающего иным механизмом действия, чем препараты платины, полезным для этих больных (при использовании в сочетании с платиной) в большей степени, чем повторение обычной схемы химиотерапии на основе платины. В исследованиях на больных с рецидивами заболевания, чувствительного к платине, после применения комбинации карбоплатин/паклитаксел ответ составлял до 90%.7,8 Однако нам неизвестны какие-либо проводившиеся ранее рандомизированные испытания по сравнению комбинации паклитаксел/платина и обычной химиотерапии на основе платины у больных с раком яичников, дающих рецидив через шесть или более месяцев после химиотерапии. В рандомизированных испытаниях ICON4 и AGO-OVAR-2.2 мы поставили вопрос об эффективности комбинации паклитаксел/платина у больных с ранее леченым раком яичников. Наша задача заключалась в том, чтобы выяснить, следует ли добавлять паклитаксел к препарату платины для лечения больных с заболеванием, чувствительным к платине, и которых в противном случае лечили бы обычными схемами на основе препарата платины.
Больные и методы
Испытания ICON4 и AGO-OVAR-2.2 проводились как параллельные испытания.
Испытание ICON4 координировалось Институтом Марио Негри (Милан, Италия) (IRFMN) и Отделом клинических испытаний Совета по медицинским исследованиям (Лондон, Великобритания) (MRC CTU). Испытание AGO-OVAR- 2.2 координировалось AGO (Карлсруэ, Германия).
Больные
Больных набирали в испытание в период с января 1996 года по март 2002 года из 119 больниц в пяти странах. Больных направляли на один из трех протоколов; один из них был координирован MRC CTU для больниц Великобритании, Норвегии и Швейцарии; один был координирован IRFMN для Италии, и один проводился под эгидой AGO. Критерии для включения больных в испытание были следующими: рецидивировавший эпителиальный рак яичников, требовавший химиотерапии; ранее проводившаяся химиотерапия с использованием препарата платины; отсутствие лечения в течение срока, превышавшего 6 месяцев (>12 месяцев для группы ICON4 в Италии); отсутствие одновременного или возникшего ранее злокачественного заболевания, могущего повлиять на лечение или его результаты; полученное после информирования письменное согласие больной на участие в испытании.
Критерии, которым должны были удовлетворять больные для участия в испытании слегка отличались для трех протоколов. По протоколу MRC CTU больным в прошлом могла проводиться более чем одна линия химиотерапии, в то время как больным, рандомизированным в соответствии с итальянским протоколом AGO, разрешалось иметь только одну предшествовавшую линию химиотерапии. Для больных, рандомизированных в соответствии с итальянскими протоколами, требовалось наличие измеряемой опухоли; это требование отсутствовало для протоколов MRC CTU или AGO. Диагноз рецидива заболевания на момент включения в испытание у 18 больных по протоколу MRC CTU был основан на повышенном уровне СА125. Больные, рандомизированные на протокол AGO, должны были ранее лечиться на схеме цисплатин/паклитаксел или карбоплатин/паклитаксел; в испытании ICON4 требовалось, чтобы больные прошли предшествовавшую химиотерапию препаратом платины с паклитакселом или без него.
Методы
Больных, рандомизировали на обычную химиотерапию препаратом платины или на аналогичную дозу препарата платины с паклитакселом, причем лечение начинали в возможно более короткие сроки после рандомизации. В соответствии со всеми протоколами курсы лечения проводились раз в три недели. В соответствии с протоколом MRC CTU каждой больной следовало провести по крайней мере шесть курсов. По итальянскому протоколу, больным назначалось по крайней мере три курса, а дальнейшие три курса назначались в зависимости от ответа на лечение. По протоколу AGO, больным назначалось, как минимум, шесть курсов и максимум восемь курсов лечения, оценка ответа на лечение проводилась после второго и четвертого курсов. Все препараты вводились внутривенно в первый день каждого из курсов. Дозу карбоплатина определяли с помощью метода площади под кривой (AUC), описанного Кальвертом с соавт.9, и она составляла, как минимум, 5 (СГФ+25) мг, где СГФ представляет собой СГФ, определявшуюся радиоизотопным методом или путем сбора суточной мочи. Если скорость гломерулярной фильтрации определяли по формуле Кокрофта, доза карбоплатина составляла, как минимум, 6 (СГФ+25) мг. Запланированная минимальная доза цисплатина только для больных испытания ICON4 составляла 75 мг/м2 при введении цисплатина в качестве единственного препарата, и 50 мг/м2, когда его вводили в комбинации с другими препаратами. Больные в испытании ICON4, назначенные на лечение комбинацией паклитаксел/платина, должны были получать паклитаксел в дозе 175 мг/м2 путем 3-часового вливания с последующим вливанием карбоплатина или цисплатина в вышеуказанной дозе. Больные в протоколе AGO, назначенные в группу лечения паклитакселом/карбоплатином, должны были получать паклитаксел в дозе 185 мг/м2 в форме 3-часового вливания с последующим вливанием карбоплатина в дозе, указанной выше.
Рандомизацию для трех протоколов проводили независимо. О всех больных собирали одинаковую информацию. Отношение рандомизации между группами лечения составляло 1:1. Для рандомизации, выполнявшейся по телефону или факсу, использовали метод минимизации на компьютере. В двух протоколах испытания ICON4 (MRC CTU и итальянский) стратификация проводилась в отношении одних и тех же факторов, а именно учреждения, возраста больного, последней проводившейся химиотерапии, времени после завершения последней химиотерапии и запланированного лечения препаратом платины. Запланированная схема лечения препаратом платины должна была быть определена до рандомизации. В протоколе AGO стратификацию проводили относительно времени после завершения последней химиотерапии, а также относительно того, проводилась или не проводилась больной вторая операция циторедукции (уменьшения массы опухоли.
Для испытания ICON4 был создан независимый комитет по мониторингу данных и этике, состоявший из двух клиницистов и одного статистика, не связанных с испытанием. Ход испытания и его незакрытые результаты, а также все прочие важные внешние данные рассматривались ориентировочно раз в год на протяжении периода записи больных в испытание. Комитет не следовал заранее определенным статистическим правилам для остановки. Для испытания AGO, комитет по мониторингу данных и этике не создавали, но протокол рецензировался и принимался местными комитетами по этике каждого из участвовавших центров.
Данные, относящиеся к периоду до лечения, собирали во время рандомизации.
Данные о лечении собирали для каждого курса. Данные последующих обследований собирали раз в три месяца на протяжении первых двух лет и раз в шесть месяцев в дальнейшем. Для сбора данных этих обследований мы использовали одностраничный формуляр, содержащий вопросы относительно заболевания, жизненного статуса, симптоматики, побочных эффектов и лечения, после последнего отчета. Все эти данные собирались, проверялись и хранились в электронном виде группами, участвовавшими в испытании.
Данные о качестве жизни собирали для всех больных, лечившихся по протоколу MRC CTU и AGO. Мы использовали анкету о качестве жизни QLQ-C30 (версия 2.0), разработанную Европейской организацией по исследованию и лечению рака (EORTC). Больные, лечившиеся по протоколу MRC CTU, заполняли анкету исходно, перед каждым курсом лечения по протоколу, а также во время визитов через 6, 9 и 12 месяцев. Больные, получавшие лечение по протоколу AGO, заполняли анкету исходно, перед вторым и третьим курсами лечения по протоколу, в конце лечения по протоколу и раз в три месяца на протяжении года после завершения лечения по протоколу.
Мы выполнили несколько анализов для подгрупп. Критерии для подгрупп включали группу рандомизации, время после завершения последней химиотерапии, число предшествовавших линий химиотерапии, проводившееся ранее лечение таксанами, препарат платины, запланированный для лечения, возраст и функциональный статус.
Статистический анализ
Главным учетным критерием была общая выживаемость; вторичными критериями были выживание без прогрессии заболевания и качество жизни. Когда проводились расчеты размеров исходной выборки, имелись лишь немногочисленные данные относительно исхода рецидивировавшего рака яичников. Мы ожидали, что двухлетняя выживаемость будет составлять около 5% для контрольной группы, а абсолютные различия в выживаемости за два года не будут превышать 5-10%.
Всего мы запланировали для испытания 800 больных, чтобы уверенное выявить абсолютные различия в выживаемости за два года, составляющие 5% (5-10%) с уверенностью 95% при уровне достоверности в 5%; это соответствует отношению риска 0,77. На завершающем заседании 8 февраля 2001 года Комитет по мониторингу данных и этике отметил, что выживание в контрольной группе было значительно более высоким, чем при исходных расчетах уверенности. Двухлетнее выживание в группе, где проводилось обычное лечение, составляло 50%. Поэтому мы пересмотрели этот вопрос. Мы рассчитали, что 800 больных будет достаточно для надежной идентификации абсолютных различий, составляющих 11% для выживаемости за два года (50-61%) с вероятностью 90% при уровне достоверности в 5%, что дает отношение риска, равное 0,71. Поэтому запланированное для испытания число больных осталось без изменений.
Мы сравнили кривые Каплана-Мейера для общей выживаемости и выживаемости без прогрессии заболевания с вариантом лог- рангового критерия Мантел-Кокса при стратификации на три группы рандомизации. Общее выживание определялось как время от момента рандомизации до летального исхода от любой причины; больные, о которых было известно, что они живы на момент анализа, учитывали на момент последнего обследования. Мы определили время выживания без прогрессии заболевания как время от момента рандомизации до первого проявления прогрессии заболевания или летального исхода от любой из причин; больные, о которых было известно, что они живы и не имеют признаков прогрессии заболевания на момент анализа, учитывали на момент проведения последнего обследования. Само по себе повышение концентрации СА125, т.е.
повышение при отсутствии клинических или радиологических признаков прогрессирующего заболевания, не считалось указанием на прогрессию заболевания. Абсолютное преимущество на конкретный момент времени рассчитывалось по выживаемости, оцененной в контрольной группе по Каплану- Мейеру на этот момент времени (выживание в контроле) и отношению риска с использованием следующего выражения: абсолютное преимущество=exp(отношение риска х log[выживание в контроле])- выживание в контроле.
Этот же подход был принят для выживания без прогрессии заболевания. Хотя такой подход косвенно предполагает наличие пропорциональных рисков, он является более предпочтителен чем учет различий между кривыми по Каплану- Мейеру в индивидуальные моменты времени. Мы рассчитывали различия в отношении медиан аналогичным образом, однако, с использованием выражения: разность медиан=(медиана контроля/отношение риска) – медиана контроля. Этот подход исходит из тог, что значения времени выживания имеют приблизительно экспоненциальное распределение.
Мы оценили относительные преимущества химиотерапии препаратами платины для выживания в опытном порядке в подгруппах, определенных на основе группы рандомизации, времени после завершения последней химиотерапии, числа предыдущих линий химиотерапии, предшествовавшего применения таксанов, препарата платины, запланированного для лечения, т.е. карбоплатина или цисплатина, возраста и функционального статуса. Для того, чтобы оценить различия в относительной величине эффекта для различных подгрупп, мы использовали критерий χ2 для взаимодействия или, в тех случаях, когда это было возможно, критерий χ2 для тренда.
Для анализа данных по качеству жизни, как это было рекомендовано, мы использовали пять функциональных шкал (физическую, ролевую, эмоциональную, когнитивную и социальную), девять шкал симптоматики (чувство усталости, тошнота и рвота, боли, одышка, бессонница, потеря аппетита, запор, понос и финансовые трудности), а также общий статус здоровья. С учетом характера рака яичников нас особенно интересовали чувство усталости, тошнота/рвота и болевая симптоматика, а также общее (глобальное) состояние здоровья в качестве общего критерия. Для каждого критерия мы анализировали два набора суммарных статистических параметров: наихудший балл и площадь под кривой за первые шесть месяецв.11 Для анализа использовался непараметрический критерий Манна- Уитни.12 Мы выбрали значение р=0,005 в качестве значения для выявления достоверности (из-за множественных сравнений).
Анализы проводились для всех больных, включенных в испытание (в англоязычной литературе -- критерий "намерение лечить"), за исключением анализа токсических эффектов. Анализы в отношении токсических эффектов ограничивались больными, получившими по крайней мере один курс назначенного лечения. Все значения р являются двусторонними. Анализ был проведен с помощью пакета SAS (версия 8.20).
Роль источника финансирования
Спонсоры испытания не играли роли в планировании испытания, сборе данных, анализе данных, интерпретации данных или написании отчета.
Результаты
В испытание было включено 802 больных. Длитеьность периода поступления больных в испытание варьировал для трех протоколов: для итальянской группы ICON4 – с января 1996 по март 2002 г.г.; для группы MRC CTU ICON4 – с мая 1996 по март 2002 г.г., и для AGO – с октября 1996 по сентябрь 1999 г.г. Четыреста десять больных было включено в группу, получавшую обычную химиотерапию на основе препаратов платины, и 392 больных в группу паклитаксел/платина (Рис. 1).
Характеристики до лечения были одинаковыми для обеих групп (Таблица 1).
Типы полученного лечения указаны в Таблице 2. 580 больных (72%) в обеих группах лечения получили минимум шесть курсов химиотерапии (Рис. 1). Причины незавершения шести курсов лечения включали следующее: прогрессия заболевания или летальный исход (109 ), токсические эффекты во время лечения 77 ) и желание больной (9 ). Только три больные не получили назначенной химиотерапии (Рис. 1). 123 (41%) из 300 больных в группе, получавшей обычное лечение, и 129 (40%) из 322 больных, получавших лечение паклитакселом и карбоплатином, получили более 90% запланированной общей дозы, а 54 (18%) из 300 больных и 76 (23%) из 330 больных, соответственно, получили более 90% общей дозы карбоплатина. Соответствующие цифры для паклитаксела в группе, получавшей паклитаксел/карбоплатин, составляли 266 (71%) из 376 больных в отношении общей дозы и 160 (43%) из 376 в отношении общей интенсивности дозы.
В Таблице 3 приведена доля больных, у которых во время лечения отмечался умеренный или тяжелый побочный эффект. Как и можно было ожидать, комбинация паклитаксел/платина давала более высокий процент алопеции по сравнению с обычной химиотерапией препаратом платины. Процент токсических эффектов умеренной или тяжелой степени в отношении кроветворения был более высоким среди больных, получавших обычную химиотерапию препаратом платины, по сравнению с группой, где лечение проводилось комбинацией паклитаксел/платина. Умеренные или тяжелые неврологические токсические эффекты отмечались у 76 (20%) больных, получавших комбинацию паклитаксел/платина. Прочие токсические эффекты были редкими в обеих группах лечения.
К марту 2003 года (среднее медианное время наблюдения 42 месяца) умерли 530 больных (66%). Кривые выживаемости соответствуют отношению риска 0,82 (95% ДИ 0,69-0,97, р=0,02; Рис. 2), что соответствует абсолютной разности в двухгодичной выживаемости, составляющей 7% в пользу химиотерапии комбинацией паклитаксел/препарат по сравнению с обычным лечением (57 и 50% ). Для медианного выживания отношение риска соответствует разности, равной 5 месяцам (29 и 24 месяца ). У 717 больных (89%) развилось прогрессирующее заболевание или они скончались. Кривые выживания без прогрессии заболевания, приведены на Рис. 3. Отношение риска, составляющее 0,76 (0,66-0,89, р=0004) в пользу схемы паклитаксел/препарат платины, соответствует оценочной абсолютной разности значений годичного выживания без прогрессии заболевания, составляющей 10% (40 и 50% ). Этот результат соответствует абсолютной разности для медианного выживания без признаков прогрессии заболевания, составляющей 3 месяца в пользу схемы паклитаксел/препарат платины (9 и 12 месяцев ).
У 69 (54%) из 128 больных в группе, получавшей обычную химиотерапию, наблюдался полный или частичный ответ на лечение, по сравнению с 78 (66%) из 119 больных в группе, получавшей схему паклитаксел/препарат платины.
Соответственно, ответ на лечение представляется лучшим для группы паклитаксел/препарат платины (разность 12% [-0,1% до 24%], р=0,06). Мы не отметили каких-либо четких признаков того, что схема паклитаксел/платина была более эффективной или менее эффективной по сравнению с обычной химиотерапией препаратом платины для любой из подгрупп по критериям общей выживаемости или выживаемости без признаков прогрессии заболевания (Рис. 4 и 5).
Детали лечения, проводившегося во время прогрессии заболевания, имелись для 437 из 536 больных. Всего 70 (31%) больных в обычной группе лечения получали при прогрессии лечение на основе препаратов таксана. В группе, получавшей комбинацию паклитаксел/платины, 16 (8%) больных продолжали получать при прогрессии дальнейшее лечение схемой на основе таксана.
В группе, использовавшей протокол MRC CTU ICON4, 482 (90%) из 536 больных заполнили анкету по оценке качества жизни исходно до начала лечения. Все шкалы для двух групп лечения были сбалансированными. Большинство больных не имели функциональных затруднений или они были незначительны, число симптомов умеренной или большой тяжести исходно было невелико. На протяжении первых шести месяцев после рандомизации значения наихудшего балла и площадей под кривыми не отличались для двух групп лечения по всем пяти функциональным шкалам, восьми из девяти шкалам симптоматики и по глобальному статусу здоровья. Единственным исключением была тошнота и рвота, которая была более тяжелой для больных, получавших обычную химиотерапию (р=0,0014 для наихудшего балла, р=0,005 для площади под кривой). На Рис. 6 приведены значения балла во времени для трех симптомов, наиболее типичных для рака яичников – чувства усталости, тошноты и рвоты, а также для боли и глобального статуса здоровья. Для глобального статуса здоровья отмечалось незначительное снижение доли больных, определяемых как имеющие нехорошее самочувствие или очень низкий статус здоровья на протяжении первых шести месяцев. Аналогичная тенденция отмечалась для чувства усталости. Напротив, болевая симптоматика в обеих группах возвращается к значениям, характерным для периода до лечения.
Хотя имеются определенные указания на различия по тошноте и рвоте в пользу группы, получавшей паклитаксел/платина, такие различия носят временный характер, относясь лишь к первым 15 неделям.
Обсуждение
С учетом данных по выживаемости без прогрессии заболевания и общей выживаемости, в нашем испытании достаточно число больных выжило и находилось в группе риска на 4-летний срок, чтобы сделать вывод о том, что общие результаты на этот срок являются надежными. Девяносто процентов больных было рандомизировано после первого рецидива, а 75% более чем через 12 месяцев после завершения химиотерапии препаратом платины. Считается, что такие больные имеют разумный прогноз. То обстоятельство, что наше испытание является крупномасштабным, позволило нам проанализировать подгруппы для оценки того, насколько однотипным является эффект комбинации паклитаксел/ платина. Тем не менее, многие из подгрупп невелики по численности и поэтому возможность выявления реальных различий невелика. Но, как бы то ни было, хорошие данные в пользу большего эффекта или меньшего эффекта комбинации паклитаксел/платины по сравнению с обычным лечением в любой из подгрупп отсутствуют. Величина эффекта комбинации паклитаксел/платина близка для разных групп рандомизации, несмотря на различия в критериях, использованных для включения больных в испытание, и факторы стратификации. Далее, нет указаний на то, что эффект комбинации паклитаксел/платина отличался для больных, которые получали таксаны в качестве составной части лечения первой линии (около 40% общего числа рандомизированных больных) и тех больных, которые таксаны не получали.
Паклитаксел в качестве индивидуального препарата сравнивался с циклофосфамидом, доксорубицином и цисплатином (схема САР) среди больных, давших ответ на химиотерапию первой линии препаратом платины, однако заболевание у которых рецидивировало после более чем 12-месячного периода отсутствия лечения.13 В испытании, о котором идет речь, у 97 больных с оцениваемым заболеванием монотерапия паклитакселом давала медианный срок без прогрессии заболевания, составлявший 9 месяцев, по сравнению с 15,7 месяцами для схемы САР (отношение риска 0,69 ). Средняя общая выживаемость составляла 25,8 месяца для монотерапии паклитакселом и 34,7 месяца для схемы САР (0,58 ). Хотя число больных недостаточно велико, чтобы сделать окончательные выводы, эти результаты позволяют полагать, что химиотерапия на основе препарата платины является важным компонентом химиотерапии при рецидиве, если заболевание остается чувствительным к платине.
Наши результаты указывают на аддитивный эффект платины и паклитаксела.
Сходные данные были отмечены в ряде испытаний первой линии (комбинация циклофосфамид 750 мг/м2 в сочетании с цисплатином 75 мг/м2 использовалась в испытании группы GOG-11114 и в испытании OV1015), но не в других испытаниях (монотерапия цисплатином в дозе 100 мг/м2; испытание GOG-13216 и карбоплатин с минимальным значением до AUC 5 или комбинация циклофосфамида 500 мг/м2, доксорубицина 20 мг/м2 и цисплатина 50 мг/м2, использовавшаяся в испытании ICON36)17. Результаты испытаний ICON3 и GOG-132 отличаются от положительного результата, отмеченного в нашем испытании, в котором 85% больных в группе паклитаксел/платина получали комбинацию карбоплатина и паклитаксела. Однако исследованные контингенты больных группы довольно различны. Женщины в нашем исследовании могут считаться имеющими чувствительное к платине заболевание и имеющими высокую вероятность ответа на дальнейшее назначение препарата платины, однако их заболевание, вероятно, менее чувствительно к платине, чем у больных, которым химиотерапия не проводилась вообще. В пользу этой теории говорит ответ на обычную химиотерапию, равный в наших условиях 54%, что слегка ниже, чем ожидается для лечения первой линии.14 Среди больных, давших рецидив заболевания, чувствительного к платине, паклитаксел может компенсировать относительное снижение чувствительности к платине. Другое возможное объяснение заключается в том, что количество платины, которое эти больные могут получить во время терапии второй линии ограничено по сравнению с количеством, которое они могут получить во время терапии первой линии. Например, лишь 40% наших больных получили более 90% общей запланированной дозы карбоплатина. Для сравнения укажем, что примерно 75% больных получили более 90% запланированной общей дозы карбоплатина в испытании ICON3 при терапии первой линии.6 Предварительные результаты испанского рандомизированного испытания по сравнению карбоплатина с комбинацией паклитаксел/карбоплатин у 81 больной с теми же самыми критериями включения в испытание, что и в протоколе MRC CTU, близки к нашим результатам в отношении процента реагирования, времени выживания без прогрессии заболевания и токсических эффектов.18 Паклитаксел в сочетании с препаратом платины обычно является более токсичной схемой, по сравнению с обычной схемой химиотерапии на основе платины, вызывая большую алопецию и неврологические токсические эффекты. Неврологические токсические эффекты отмечались у 20% больных, что близко к цифрам, наблюдающимся при лечении первой линии.6 Эта доля меньше по сравнению с ожидаемой, в частности поскольку треть больных ранее получала препарат таксана. Опыт исследований Дизона и соавт.8 является сходным, и применение доцетаксела у 3% наших больных могло внести определенный, хотя и незначительный вклад в меньший процент периферического неврита. Однако соблюдение назначенных правил лечения было хорошим, причем 72% больных завершили по крайней мере шесть курсов лечения. Другой причиной, конечно, могло быть то, что больные со склонностью к развитию нейропатий не вошли в испытание из-за опыта полученного ими во время лечения первой линии. Обычная химиотерапия препаратом платины связана с более серьезными токсическими эффектами в отношении кроветворения по сравнению со схемой паклитаксел/платина, что глвлрит в поддержку опубликованных ранее сообщений, что паклитаксел может оказывать защитное воздействие на костный мозг.19 Лечение рецидивов рака яичников содержит значительный паллиативный компонент. Поэтому оценка больной собственного качества жизни является важной, чтобы сказать, будет ли схема паклитаксел/платина иметь какие-либо недостатки по отношению к обычной химиотерапии препаратом платины (или наоборот) с точки зрения связанных с лечением токсических эффектов и бессимптомного интервала. Мы не обнаружили ясных указаний, что какая-то из использованных схем является хуже другой в отношении функциональных аспектов, симптоматики или глобального статуса здоровья.
Наши результаты говорят о положительном эффекте комбинации паклитаксел/платина на общую выживаемость и выживаемость без прогрессии заболевания в группе больных с рецидивом чувствительного к платине рака яичников. Паклитаксел чаще всего комбинировали с карбоплатином, а наиболее часто применявшаяся обычная схема химиотерапии препаратом платины включала использование карбоплатина в качестве единственного агента. Поэтому мы полагаем, что все женщины, у которых рецидив развивается позже, чем через 6 месяцев после завершения химиотерапии препаратом платины, должны рассматриваться в качестве кандидатов на комбинированную химиотерапию платиной и паклитакселом, даже если они получали паклитаксел в качестве составной части схемы лечения первой линии.
Заявление о конфликте интересов J.A.Lederman получил небольшой гонорар за специальные консультации компании Бристол-Майерс Сквибб.
Таблица 1. Группы рандомизации и исходные характеристики больных
|
Характеристика |
Обычная ХТ |
Паклитаксел+платина |
|
Численность в группе рандомизации |
||
|
Возраст (годы) |
||
|
Функциональный статус по ВОЗ |
||
|
Планируемый препарат платины |
||
|
Карбоплатин |
||
|
Цисплатин |
||
|
Последняя химиотерапия |
||
|
Паклиатаксел и карбоплатин |
||
|
Карбоплатин |
||
|
Паклитаксел и цисплатин |
||
|
Доцетаксел и карбоплатин |
||
|
Другие препараты на основе платины |
||
|
Другие препараты |
||
|
Число предшествующих линий химиотерапии |
||
|
Неизвестно |
||
|
Время после завершения последней химиотерапии (месяцы) |
||
Таблица 2. Лечение по протоколу во время испытания
|
Обычная ХТ |
Паклитаксел+платина |
|
|
Лечение |
||
|
Карбоплатин (моно) |
||
|
Карбоплатин и цисплатин* |
||
|
Цисплатин и доксорубицин |
||
|
Цисплатин (моно) |
||
|
Карбоплатин в комбинации (не с таксаном) |
||
|
Паклитаксел и карбоплатин |
||
|
Паклитаксел и цисплатин |
||
|
Паклитаксел, карбоплатин и цисплатин* |
||
|
Паклитаксел (моно) |
||
|
Лечение не проводится или неизвестно |
||
Таблица 3. Умеренные или тяжелые побочные эффекты во время лечения
|
Токсические эффекты |
Обычная ХТ |
Паклитаксел+платина |
|
Неврологические (степени 2-4) |
||
|
Неизвестно |
||
|
Гематологические* |
||
|
Неизвестно |
||
|
Инфекции* |
||
|
Неизвестно |
||
|
Неизвестно |
||
|
Мукозиты (степени 2/3) |
||
|
Неизвестно |
||
|
Тошнота и рвота (степени 2-4) |
||
|
Неизвестно |
||
|
Алопеция (степени 2-4) |
||
|
Неизвестно |
Литература
1 Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000: the global picture.Eur J Cancer
2001; 37:
S4–66.
2 The ICON collaborators. ICON2: randomised trial of single-agent carboplatin against three-drug combination of CAP (cyclophosphamide, doxorubicin, and cisplatin) in women with ovarian cancer. Lancet
1998; 352:
1571–76.
3 Advanced Ovarian Cancer Trialists’ Group. Chemotherapy in advanced ovarian cancer: four systematic meta-analyses of individual patient data from 37 randomized trials. Br J Cancer
1998; 78:
1479–87.
4 Markman M, Reichman B, Hakes T, et al.
Second-line platinum therapy in patients with ovarian cancer previously treated with cisplatin. J Clin Oncol
1991; 9:
389–93.
5 Trimble EL, Adams JD, Vena D, et al.
Paclitaxel for platinum-refractory ovarian cancer: results from the first 1,000 patients registered to National Cancer Institute Treatment Referral Center 9103. J Clin Oncol
1993; 11:
2405–10·6
6 The International Collaborative Ovarian Neoplasm (ICON) Group. Paclitaxel plus carboplatin versus standard chemotherapy with either single-agent carboplatin or cyclophosphamide, doxorubicin, and cisplatin in women with ovarian cancer: the ICON3 randomised trial. Lancet
2002; 360:
505–15.
7 Rose PG, Fusco N, Fluellen L, et al. Second-line therapy with paclitaxel and carboplatin for recurrent disease following first-line therapy with paclitaxel and platinum in ovarian or peritoneal carcinoma. J Clin Oncol
1998; 16:
1494–97.
8 Dizon DS, Hensley ML, Poynor EA, et al. Retrospective analysis of carboplatin and paclitaxel as initial second-line therapy for recurrent epithelial ovarian carcinoma: application toward a dynamic disease state model of ovarian cancer. J Clin Oncol
2002; 20:
1238–47.
9 Calvert AH, Newell DR, Gumbrell LA, et al. Carboplatin dosage: prospective evaluation of a simple formula based on renal function. J Clin Oncol
1987; 7:
1748–56.
10 Parmar MKB, Machin D. Survival analysis: a practical approach. Chichester: John Wiley, 1995.
11 Fayers PMF, Aaronson NK, Bjordal K, Curran D, Groenvold M, on behalf of the EORTC Quality of Life Study Group. EORTC QLQ-C30 scoring manual, 3rd edn.
Brussels: European Organisation for the Research and Treatment of Cancer, 2001: 86.
12 Girling D, Parmar MKB, Stenning S, Stephens R, Stewart L. Clinical trials in cancer.
Oxford: Oxford University Press, 2003.
13 Cantu MG, Buda A, Parma G, et al. Randomized controlled trial of single-agent paclitaxel versus cyclophosphamide, doxorubicin, and cisplatin in patients with recurrent ovarian cancer who responded to first-line platinum-based regimens. J Clin Oncol
2002; 20:
1232–37.
14 McGuire WP, Hoskins W, Brady MF, et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N Engl J Med
1996; 334:
1–6.
15 Piccart MJ, Bertelsen K, James K, et al. Randomized intergroup trial of cisplatinpaclitaxel versus cisplatin-cyclophosphamide in women with advanced epithelial ovarian cancer: three-year result. J Natl Cancer Inst
2000; 92:
699–708.
16 Muggia FM, Braly PS, Brady MF, et al. Phase III randomized study of cisplatin versus paclitaxel versus cisplatin and paclitaxel in patients with suboptimal stage III or IV ovarian cancer: a gynecologic oncology group study. J Clin Oncol
2000; 18:
106–15.
17 Sandercock J, Parmar MKB, Torri V, et al. First-line treatment for advanced ovarian cancer: paclitaxel, platinum and the evidence. Br J Cancer
2002; 87:
815–24.
18 Gonzalez Martin AA, Calro E, Bover I, et al. Randomised phase II study of carboplatin versus paclitaxel-carboplatin in platinum-sensitive recurrent advanced ovarian carcinoma with assessment of quality of life: a GEICO study (Spanish Group for Investigation on Ovarian Carcinoma). Proc ASCO
2003; 22:
(abstr 1812).
19 van Warmerdam LJ, Huizing MT, Giaccone G, et al. Clinical pharmacology of carboplatin administered in combination with paclitaxel. Semin Oncol
1997; 24
(suppl 2):
97–104.
Рис. 1. Профиль испытания
Рис. 2. Общая выживаемость 
Рис. 3. Выживание без прогрессии 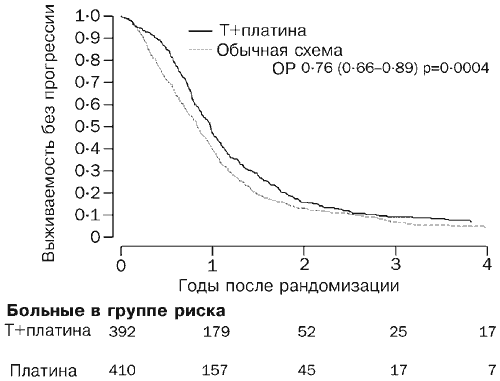
Рис. 4. Эффект XT комбинацией Т+платина на общую выживаемость в подгруппах 
*Взаимодйствие
Тренд
Сокращения: Т - паклитаксел; XT - химиотерапия; ФС - функциональный статус.
Относится к основным методам лечения злокачественных опухолей. Используемые в процессе лечения препараты направлены на уничтожение раковых клеток или подавление процесса их размножения. Применение химиотерапии позволяет увеличить продолжительность жизни пациента, уменьшить выраженность симптомов.
Сколько стоит лечение?
На стоимость химиотерапии влияют следующие факторы:
- Условия проведения. Лечение может проводиться как в стационаре, так и амбулаторно. При проживании в стационаре стоимость будет выше. Однако даже при желании сократить стоимость курса химиотерапии, необходимо учитывать, что не всегда есть возможность провести эффективное лечение амбулаторно.
- Цена препаратов. В лечении применяются несколько различных категорий препаратов. Могут использоваться не только оригинальные средства, но и дженерики – медикаменты с аналогичным составом, однако выпускаемые другой компанией. Такие аналоги стоят дешевле.
- Протокол лечения. Схемы лечения, предназначенные для терапии одного и того же типа опухоли, могут быть разными и включать в себя различные списки медикаментов. Следовательно, когда назначена химиотерапия, стоимость может варьироваться в зависимости от набора препаратов.
- Вспомогательное лечение и дополнительные процедуры. Специальная подготовка может потребоваться перед проведением химиотерапии: она необходима для снижения риска развития побочных действий, уменьшения их интенсивности. Обязательно должна проводиться поддерживающая терапия во время лечения, а также прием препаратов после завершения курса для восстановления нарушенных функций.
- Использование других методов. Помимо химиотерапии пациент может нуждаться и в другой медицинской помощи: проведении хирургического вмешательства, лучевой терапии, применении таргетных, гормональных препаратов. В зависимости от перечня этих методов будет меняться стоимость химиотерапии при раке.
Препараты, которые могут использоваться
При проведении химиотерапии могут использоваться препараты следующих групп:
- алкилирующие;
- антрациклины;
- производные платины;
- раковые антилиотики;
- винкалкалоиды;
- цитостатики;
- таксаны.
Необходимо учитывать, что препараты, используемые при химиотерапии, работают в отношении активных клеток. Это означает, что при наличии большого количества клеточных структур, находящихся в спящей фазе, опухоль может быть достаточно устойчива к их воздействию.
Алкилирующие агенты
Под воздействием препаратов происходит гибель клеток опухоли вследствие подавления синтеза определенных белков.
Опасность применения этих средств заключается в вероятности возникновения лейкемии.
К алкилирующим агентам относятся:
- Циклофосфамид;
- Эмбихин;
- Ифосфамид;
- Хлорамбуцил.
Ниже приведены примеры препаратов этой категории, которые используются при химиотерапии, цена варьируется:
- Винбластин;
- Винкристин;
- Винорельбин.
Антибиотики противораковые
Препараты, предназначенные для замедления генного деления раковых клеток. Побочные эффекты при использовании медикаментов этой категории чаще возникают в отношении легочных структур, т.к. оказывается токсическое воздействие на легкие.
Чаще всего используются: Адриамицин, Блеомицин. Наиболее распространенной является комбинация с Цитотоксином.
- Митомицин;
- Эпирубицин.
Антрациклины
Это вещества, повреждающие ДНК онкоклеток. К антрациклинам относятся Даунорубицин, Доксорубицин. Это препараты, изготавливаемые из натурального сырья. Действующим компонентом является составляющая почвенных грибков. Антрациклины – препараты, показывающие свою эффективность в борьбе с онкоклетками, однако они имеют и множество побочных эффектов, связанных с работой сердечно-сосудистой системы.
- Адрибластин;
- Заведос;
- Доксорубицин.
Антиметаболиты
Вещества, которые встраиваются в генетический клеточный код. Происходящие изменения приводят к тому, что в процессе деления происходит гибель клетки.
Препараты этой категории: Метотрексат, Гемзар, Гемцитабин. Одним из широко применяемых средств является 5-фторурацил. Он давно используется в химиотерапии раковых опухолей и показал свою эффективность, однако также характеризуется побочными действиями. Он может повлиять на костный мозг, спровоцировать интоксикации ЖКТ, выработку нейротоксинов, которые приводят к возникновению судорог, коме.
Когда необходима химиотерапия, цена на препараты может стать ключевым фактором, определяющим выбор. Антиметаболиты в аптеке представлены в разных ценовых категориях:
- Метотрексат;
- Фторурацил;
- Кселода;
- Меркаптурин.
Производные платины
Относятся к тяжелым токсичным металлам. Наиболее распространены:
- Цисплатин (оказывает сильное токсическое воздействие на почки);
- Карбоплатин (препарат 2-го поколения, токсическое действие меньше);
- Оксалиплатин (перпарат 3-го поколения, на почки негативного воздействия не оказывает, однако может привести к невропатиям).
Цитостатики
Цитостатики действуют по принципу алкилирующих агентов или антиметаболитов. Наиболее распространенными являются Капецитабин, Таксол.
Таксаны
Таксаны используются при раке легкого, и . В качестве побочного эффекта называются снижение качества клеток крови.
Препараты, которые применяются для восстановления после химии
С целью восстановления назначаются традиционные медикаменты и фитопрепараты. Восстанавливающую терапию можно начинать еще в ходе ХТ, либо сразу после нее.
Критично снижается уровень лейкоцитов, иммунитет снижается в разы. Для восстановления иммунной функции применяют Имунофол, Полиоксидоний.
При отсутствии необходимого эффекта их заменяют более сильнодействующими средствами: Батилол, Лейкоген, Цефарансин, Метилурацил.
На печень оказываются очень серьезные нагрузки, так как ей приходится выводить огромное количество токсинов. Для восстановления применяют:
- Гепастерил;
- Гепамин;
- Сирепар;
- Карсил.
Дисфункция почек проявляется постоянной рвотой, диареей. Восстановление органа проводится при помощи Уропрота, Урометоксана.
Для восстановления сердечно-сосудистой системы применяют: Аспаркам, Предуктал, Милдрокарт.
Множество побочных эффектов при химиотерапии развивается со стороны кишечника и пищеварительной системы. С тошнотой, рвотой, диареей сталкивается каждый пациент. Прием препаратов сопровождается воспалительным процессом в кишечнике, и на сегодняшний день нет лекарства, которое могло бы полностью предотвратить воспаление.
Для восстановления используют такие препараты как:
- Проксиум;
- Нексиум;
- Квамател.
Профилактика депрессии. На фоне комбинирования препаратов при химиотерапии развивается дуоденальная депрессия. Возникает она из-за синтезирования в 12-перстной кишке ряда гормонов. Воспаление приводит к нарушению баланса нейропептидов.
Из лекарственных препаратов используют:
- Афабазол;
- Фезам.
От чего еще зависит стоимость?
Химиотерапия проводится курсами. После окончания одного курса необходим перерыв для восстановления. Продолжительность и число циклов, общая продолжительность лечения будет зависеть от типа, стадии рака, применяемых препаратов. Все это повлияет на цену лечения в целом. Стоимость химиотерапии зависит от формы выпуска препаратов, объема, который необходимо для лечения.
Помимо цены на препараты, которая не всегда составляет основную долю затрат, цена химиотерапии при раке, озвученная медцентрами, подразумевает оплату услуг без учета медицинских препаратов.
Здесь также необходимо отметить, что может быть существенная разница между ценами в государственных центрах и частных клиниках.
Стоимость химиотерапии в Москве зависит от выбранного заведения, и классифицируется на следующие виды:
- фракционное введение химиотерапевтического препарата (химиотерапия цена за 1 курс);
- инфузионное введение химиотерапевтического препарата;
- дозированные инфузии;
- круглосуточные инфузии химиопрепаратами.
Продолжительность лечения
Химиотерапия осуществляется обычно внутривенно. Средняя продолжительность лечения – 2-3 недели.
Онкология легких – лечение внутривенное, продолжительность – 2,3,4 недели.
Онкология матки. Применяются сочетания Таксола, Доксорубицина, Карбоплатина, Цисплатина.
Как правило, используются 2 и более препаратов.
Онкология яичников. Целесообразно использовать препараты платины в комбинации с Паклитакселом, Доцетакселом. Подразумевает внутривенное введение.
Онкология желудка. Препараты могут применяться перорально или внутривенно. Продолжительность цикла лечения может составлять 14,21,28 дней.
Если проводится за границей химиотерапия, стоимость будет выше. Например, стоимость химиотерапии в Германии примерно следующая:
- опухоль соединительной ткани при 7дневном пребывании в клинике при высокосложной терапии – от 6 до 12 тысяч евро;
- при локальной химиотерапии – от 4 до 7,5 тысяч евро;
- средне-сложная химиотерапия – 4,5-7,5 тысяч евро.
При этом нужно прибавить затраты на дорогу.
Стоимость химиотерапии будет зависеть, в том числе и от того, на какой стадии находится заболевание. Если опухоль по размеру небольшая и не успела сформировать метастазы, лечение пройдет легче и быстрее. Как и в любом другом заболевании при раке очень важно как можно скорее обнаружить новообразование и безотлагательно принять меры. Не следует откладывать лечение, при выявлении новообразования необходимо сразу записаться на прием к онкологу.
Лекарственные средства, разработанные для активного подавления роста и размножения атипичных клеток в злокачественных новообразованиях – химиотерапевтические препараты. Благодаря их применению удается справиться с различными по структуре, локализации и размерам опухолями. Это наиболее эффективный из всех, существующих на сегодняшний момент, методов борьбы с раком.
Подбор химиопрепаратов осуществляется специалистом как на ранних этапах формирования онкозаболевания, на предоперационной стадии, так и после проведения оперативного вмешательства. Возможно использование только одного лекарства – монохимотерапия. Однако, чаще прибегают к комбинации медикаментов – полихимотерапия. Подобная тактика признается более эффективной, позволяющей достичь максимума поставленных целей.
Виды и механизм действия антираковых средств
Разработка действенных противоопухолевых препаратов, обладающих способностью подавить рост и размножение атипичных клеток, без негативного воздействия на здоровые ткани – главная цель фарминдустрии наших дней.
Механизм действия химиопрепаратов таков, что они, проникая через оболочку раковых элементов, способствуют разрушению, прекращению существования мутировавшей клетки. Однако, существующие и активно используемые специалистами для избавления от онкологии медикаменты, не могут похвастаться своей безопасностью. Каждый из них имеет ряд побочных эффектов – от легкой тошноты и слабости, до выраженных диспепсических и пищеварительных расстройств.
Выраженность восприимчивости очага атипии к препаратам для химиотерапии определяется стадией онкологического процесса, числом клеток, которые находятся в покое. Так, при быстром росте и делении элементов, они менее резистентны к цитостатикам. Шансы на выздоровление выше.
Химиотерапевтические средства, применяемые онкологами на сегодняшний момент:
- алкилирующие агенты и таксаны;
- антрациклины и цитостатики;
- платиновые препараты и винкаалкалоиды;
- антираковые антибиотики.
Каждая подгруппа имеет свои особенности применения и способности воздействовать на фазы жизнедеятельности раковых клеток.
Алкилирующие агенты
Старейший класс препаратов химиотерапии при раке различной локализации и стадии развития – алкилирующие агенты. Почти все они являются производными азотистых ипритов – ядовитых соединений, способных вызывать ошибку в механизме считывания генетической информации в клетке. Процесс приводит к подавлению формирования соответствующих белков – разрывам ДНК.
Химиотерапевтические препараты этой подгруппы способны проявлять требуемую от них активность на каждом этапе клеточного цикла. Поэтому они заслуженно признаются мощными и высокоэффективными. Их обязательно включают в комплексное лечение практически всех разновидностей злокачественных новообразований.
Однако, в силу своей токсичности, алкилирующие средства имеют и ряд ограничений к приему – к примеру, период вынашивания малыша. Из нежелательных последствий указываются сокращение образования спермы у мужчин и сбои менструального цикла у женщин, а также высокий риск появления вторичных новообразований – лейкемии. Даже через несколько лет после окончания противоопухолевой терапии.
Все эти факторы обязательно учитываются онкологами при подборе ими оптимальной схемы полихимиолечения.
Противораковые антибиотики
При диагностировании онкологии также могут быть рекомендованы к приему антибиотические средства – довольно существенно отличаемые от общеизвестных медикаментов, применяемых, к примеру, при бронхите или пневмонии.
Механизм противораковых антибиотиков заключается в способности замедлять течение генного деления в атипичных клетках. Именно влияние на различные фазы существования раковых элементов, помогает им занять свою нишу среди препаратов химиотерапии при новообразованиях.
Яркие представители подгруппы – Блеомицин, а также Адриамицин довольно опасны для легочных структур, поскольку создаваемые ими токсические соединения крайне негативно отражаются на детальности дыхательной системы.

Чтобы снизить риск формирования нежелательных эффектов, химиопрепараты этой подгруппы обязательно комбинируют с иными противораковыми медикаментами. Оптимальная схема подбирается специалистами индивидуально – в прямой зависимости от диагностированной онкопатологии.
Антрациклины
Присутствие специфического антрациклинового кольца, способного взаимодействовать с ДНК атипичных клеток, помогает антрациклинам действенно разрушать саму структуру опухоли. Химиотерапевтические препараты этой подгруппы могут значительно подавлять реакции и механизмы, протекающие при выделении фермента топоизомеразы, а также формировать свободные радикалы.
Все это приводит к требуемому эффекту – повреждению структурной основы ДНК раковых элементов. Стоит, однако, учитывать, что на фоне их применения могут появиться такие осложнения, как токсическое воздействие на миокард, а также иные ткани. Так как свободные радикалы, лежание в основе противоопухолевой терапии антрациклинами, могут приводить к значимым повреждениям миокардиоцитов. Поэтому требуется обязательный контроль со стороны лечащего врача, проведение различных диагностических мониторинговых процедур, в том числе ЭКГ.
Отдельные представители – препарат «Даунорубицин» либо «Доксорубицин» были выработаны из мутагенных штаммов почвенных грибов. Они помогают бороться с онкологией благодаря выработке свободных радикалов кислорода, который приводит к разрывам в цепочке ДНК атипичных клеток.
Винкаалкалоиды
Препараты химиотерапии, имеющие, как правило, растительное происхождение всегда приветствуются специалистами и самими онкобольными. К подобной подгруппе относят средства на основе экстракта листьев барвинка – к примеру, Винккристин, либо Винбластин, а также Винорелбин.
Перечисленные химиопрепараты обладают способностью быстро связываться с тубулином – специфическим белком, из которого формируется цитоскелет. Все это приводит к сбою митотических процессов и уничтожению онкоклеток.
Винкаалкалоиды выгодно отличаются тем, что структура злокачественных новообразований высоковосприимчива к их компонентам, в отличие от здоровых клеток. Поэтому нежелательные последствия сведены к минимуму. К таковым можно отнести нейротоксичность.

Благодаря своим особенностям медикаменты из подгруппы винкаалколоидов нашли свою нишу в противоопухолевой терапии, как у женщин, так и представителей сильной части населения. Обязательно учитывается отсутствие у человека аллергического компонента на экстракт барвинка.
Антиметаболиты
Препараты, обладающие способностью активно вмешиваться в процесс создания ДНК атипичными клетками, именуются антиметаболитами. Наиболее широко применяется Антифолат – в комплексной терапии новообразований молочной железы, лимфом, а также лейкемии и сарком, хариокарцином.
Еще один высокоэффективный антиметаблит, срывающий выделение нуклеотидов – 5-Фторурацил. Его спектр противоопухолевого воздействия отличается широтой – раковые очаги в петлях толстого кишечника, а также в тканях головы и шеи, помимо этого, в поджелудочной железе и пищеводе.
Из токсических последствий химиотерапии препаратом 5-Фторурацилом – подавление деятельности костного мозга, а также тяжелые желудочно-кишечные отравления и формирование нейротоксинов. Все это обязательно учитывается онкологом перед началом полихимиолечения – больному проводится специальный тест на присутствие в его организме DPD. Отсутствие этого природного фермента никоим образом не сказывается на функциональных способностях человека, однако, при его низких параметрах возникает тяжелое токсическое отравление.
К антиметаболитам также относят – Цитарабин и Гемцитабин, а также Флударабин и 6-Меркаптопурин. Все они имеют свои особенности по приему и продолжительности противоопухолевого лечения.
Препараты платины
Современные и высокоэффективные химиотерапевтические препараты, способные бороться с локализациями рака, против которых оказались бессильными иные средства – производные природного металла платины.
После проникновения в организм онкобольного, компоненты платиновых средств начинают напрямую взаимодействовать с ДНК молекулами атипичных клеток, разрушая их и приводя к нарушению функциональной активности. Раковые очаги гибнут.

Платиновые соединения могут воздействовать практически на любом клеточном цикле. Поэтому спектр их противоопухолевой активности довольно широк. Так, Цсиплатин чаще включается в схему лечения подавления опухоли в структуре легких либо яичек. Тогда как, Карбоплатин отлично зарекомендовал себя в борьбе с раком яичников, шейки матки, мочевого пузыря, а также семиномах и остеогенных саркомах.
Представителем третьего поколения препаратов платины, менее токсичных для человеческого организма, можно назвать Оксалиплатин. Он максимально активен при злокачественных поражениях петель толстого кишечника и структур печени, а также поджелудочной железы. Тогда как для почечной паренхимы он представляет минимальную опасность. Основным нежелательным эффектом, формирующимся на фоне его применения, называется невропатия.
Таксаны
Медикаментозные средства, оказывающие губительное воздействие на раковые очаги посредством нарушения процессов их деления – таксаны. К примеру, Доцетаксе либо Паклитаксел, стабилизируя микротрубочки клеточной оболочки атипичных элементов, не допуская их деполимеризации. Все это нарушает течение процессов реструктурирования микротрубочек и деления мутировавших клеток не происходит.
Спектр применения таксанов довольно широк – раковые очаги в легочной системе, молочной железе, а также простате и пищеводе. Включаются они в схему противоопухолевой терапии новообразований головы, яичников, желудка.
Их нежелательных последствий чаще диагностируется изменение параметров кровяных элементов. Поэтому отслеживание формулы крови – одно из обязательных условий применения таксанов.
Каптотецины
Химиопрепараты подкласса каптотециной борются с новообразованиями путем формирования особого комплекса с ДНК-топоизомеразы. Итогом становится понижение выделения этого фермента, а также его функциональной активности.
Топоизомераза требуется для размножения и деления атипичных клеток. Поэтому отсутствие фермента приводит к разрушению опухолевого очага. Каптотецины отлично зарекомендовали себя в антираковом лечении, как твердых новообразований, так и полостных. Необходимость их присутствия в полихимиотерапии определяется онкологами в индивидуальном порядке.
Побочные эффекты могут значительно отличаться для каждого из препаратов. Поскольку, и Иринотекан, и Топотекан, а также Этопозид – специфические алколоиды, они способны оказывать токсическое воздействие и на здоровые ткани организма онкобольного. Преимущественно, вводимая химиотерапия в таблетках, сказывается на деятельности почечных и печеночных структурах, поскольку именно ими перерабатывается и выводится наружу.
Антираковые средства последнего поколения

Фарминдустрия находится в постоянном поиске новых, более эффективных препаратов для борьбы с таким грозным своими осложнениями заболеванием, как рак. Специалисты ежегодно предлагают все новые комбинации медикаментов, способных подавить не только рост уже сформировавшихся злокачественных новообразований, но и предупредить формирование новых, вторичных очагов.
Химиолекарства последнего поколения, как правило, имеют гораздо меньший перечень нежелательных воздействий на организм онкобольных, что довольно актуально. Ведь пациенты и без того тратят огромные силы на борьбу с раковыми мутациями, а различные медикаменты подрывают своими токсичными соединениями защитные механизмы.
К наиболее безопасным и высокоэффективным антираковым препаратам относят:
- Авастин и Сандостатин;
- Гливек и Фемара;
- Оксалипплатин и Карбоплатин;
- Зомера и Талидомид.
Все чаще онкологи стараются прибегать к таргентной схеме химиотерапии, подразумевающей применение медикаментов, способных распознавать именно атипичные элементы и воздействовать на них. При этом, не затрагивая здоровые ткани и органы.
Для некоторых онкобольных многие традиционные химиотерапевтические средства оказываются противопоказаны – чересчур уж они токсичные. Выходом представляется применять медикаменты – новинки на фармрынке противоопухолевой терапии. Цитостатики обладают комбинированным механизмом противоракового воздействия, схожим с вышеописанными подгруппами.
Лучшими медикаментами для химиотерапии, безусловно, признаются те, что при минимальных дозах, вводимых или перорально, или парентерально, способны оказывать максимальный противораковый эффект. Подбор подобных средств – прерогатива онколога. Самолечение абсолютно не допустимо – чересчур велик риск формирования тяжелых, порою летальных последствий.
- Информатизация и образование Стратегическое позиционирование вузовской науки: инсайдерское видение и государственная позиция
- Информатизация и образование Стратегическое позиционирование вузовской науки: инсайдерское видение и государственная позиция
- Становление патопсихологии
- Становление патопсихологии
- Как приготовить тортилью
- Как приготовить тортилью
- Имбирный чай — рецепты приготовления

 Live Journal
Live Journal Facebook
Facebook Twitter
Twitter